3. Atomun Yapısı Nasıldır? Hakkında Detaylı Anlatım
Normal hâlde atomları nötr olan cam çubuğun ipekli, plastik çubuğun yünlü kumaşa sürtülmesiyle elektriklendiğini ve farklı yüklerle yüklendiğini biliyoruz. Neden cam ve plastik çubuklar farklı yüklerle yükleniyor olabilir?
Atomik yapıları ile ilgilidir. Plastik çubuk elektron aldığı için negatif (–) olur. Cam çubuk elektron verdiği için pozitif (+) olur.
Sürtünen maddelerin farklı yüklerle yüklenmesi bu maddelerden birinin elektron verme yatkınlığının diğerinden daha fazla olmasıyla açıklanabilir. Cam çubuk, ipek kumaşa sürtüldüğünde cam çubuktan ipek kumaşa elektron geçer. Cam çubuktaki bazı atomlarda elektron eksikliği oluşur. Elektron eksikliği, “Cam çubuk pozitif (+) yükle yüklendi.” şeklinde ifade edilir. Plastik çubuk örneğinde ise elektronlar yünlü kumaştan plastik çubuğa geçer ve plastik çubuktaki bazı atomlarda elektron fazlalığı oluşur. Elektron fazlalığı, “Plastik çubuk negatif (-) yükle yüklendi.” şeklinde ifade edilir (Şekil 4.6)
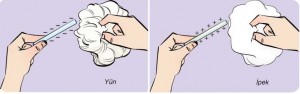
Şekil 4.6: Cam ve plastik çubuğun sürtme ile elektriklenmesi
Acaba atom altı taneciklerin kütlece en küçüğü hangisidir? Atom altı tanecikler tartılamayacak kadar küçüktür. Ancak bilim insanları atom altı taneciklerin kütlelerini dolaylı yollarla ölçebilmektedir. Bu ölçümler proton ve nötronun kütlelerinin birbirine çok yakın olduğunu ve elektronun kütlesinin, protonun kütlesinin yaklaşık 1 /2000’i kadar olduğunu göstermektedir.
Elektronların kütleleri o kadar azdır ki atomun kütlesine belirgin bir katkıları yoktur (Şekil 4.7). Bu nedenle atomun kütlesi yaklaşık olarak proton ve nötronların kütlelerinin toplamı kadardır.
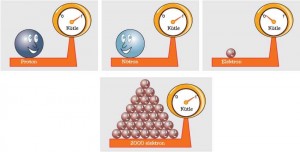
Şekil 4.7: Proton, nötron ve elektronun kütlelerinin karşılaştırılması
Bu kadar küçük olan atomları ve atom altı tanecikleri, en gelişmiş araçlarla bile gözlemlemek mümkün değildir. Bu nedenle atomun yapısını anlamak için madde modelleri gibi atom modelleri kullanılır. Şekil 4.8’de periyodik tablodaki ilk 20 elementin atom modelleri verilmiştir. Modelleri inceleyerek her atom modelindeki elektron sayılarını belirleyiniz. Nötr atomların proton sayıları ile elektron sayıları arasında nasıl bir ilişki olduğunu bulmaya çalışınız.

Şekil 4.8: Atom modelleri
Şekil 4.8’de incelediğiniz atom modelleri iki boyutlu olsa da üç boyutlu küreyi temsil etmektedir. Çünkü gerçekte atomlar üç boyutlu küre şeklindedir. Kürenin merkezinde yer alan atom çekirdeğinin atomda kapladığı yer de modellerde gösterildiği kadar büyük değildir. Atomun hacminin büyük bir kısmı boşluktur. Eiffel (Eyfel) Kulesi’ndeki atomların içindeki boşluğu yok etmek mümkün olsaydı geriye bir şeker kutusu büyüklüğünde cisim kalırdı. Bu kutuyu en güçlü vinçler bile kaldıramazdı çünkü kulenin kütlesi değişmezdi.
Şekil 4.8’deki atom modellerini ve Bulalım etkinliğinde doldurduğunuz tabloyu incelediğinizde her atomda proton ve elektron sayısının eşit olduğunu fark ettiniz mi? Peki, atomun elektrik yükünü bulmak için neden proton sayısından elektron sayısı çıkarılır? Nötr bir atomda proton ve elektron sayıları eşittir. Bu nedenle de atomun yapısında bulunan elektronla protonun elektrik yük miktarları birbirine eşittir. Yani protonun +1 birim yüke sahip olduğunu düşünürsek elektron da -1 birim yüke sahip olur.
Şekil 4.8’deki atom modellerinin proton sayıları ile ilk yirmi elementin sıra numaralarını karşılaştırınız. Elementlere verilen bu numaralar atomlardaki proton sayısına eşittir. Atom çekirdeğinde bulunan proton sayısı atom numarası olarak adlandırılır. Atom numarası bir atomun kimliğidir. Atom numarası (proton sayısı) aynı olan atomlar, nötron ve elektron sayıları farklı olsa bile aynı elementin atomlarıdır.
Atom modellerinde de gördüğünüz gibi elektronların çekirdekten uzaklığı aynı değildir. Atomda elektronlar belli bölgelerde bulunur. Elektronların bulunduğu bölgelere katman denir (Şekil 4.9). Katmanlar içten dışa doğru 1’den başlayarak numaralandırılır. Örneğin, hidrojen atomunda bir elektron, helyum atomunda iki elektron 1. katmanda bulunur. Üç elektronu olan lityum atomunda iki elektron 1. katmanda, üçüncü elektron 2. katmanda yer alır.
Şekil 4.9’da gösterilen elektron katmanlarını inceleyiniz. Potasyum atom modelindeki katmanları da sırasıyla siz gösteriniz. Bu atom modellerinin her bir katmanında kaç elektron bulunduğunu içten dışa doğru sayınız.
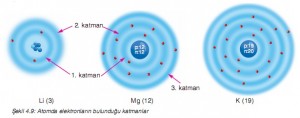
Şekil 4.9: Atomda elektronların bulunduğu katmanlar
Şekil 4.9’daki atom modellerini inceleyiniz ve aşağıdaki soruları cevaplayınız:
1. Çekirdeğe en yakın katman olan 1. katmanda en fazla kaç elektron bulunabilir?
Çekirdeğin en yakınıdaki katmanda en fazla 2 adet elektron bulunabilir.
2. Atomun 2 ve 3. katmanlarında en fazla kaçar elektron bulunabilir?
Atomun 2. katman ve 3. katmanların en çok 8 elektron bulunabilir.
Atomların, model resimlerinde görüldüğü gibi iki boyutlu olmayıp üç boyutlu küreler gibi olduğunu
öğrenmiştiniz. Bu durumda elektronların hareket alanı bir çember değil küredir. Dolayısıyla katmanlar da küre yüzeyleridir (Şekil 4.10). Aynı atomda elektronlar çekirdeğe farklı uzaklıklardaki katmanlarda bulunur. Bu katmanlara elektronlar belirli bir düzene göre yerleşir. Atomlarda birden fazla katman bulunabilir. İlk katmanda en fazla iki elektron, ikinci ve üçüncü katmanlarda ise en fazla sekizer elektron bulunabilir. Bulalım etkinliğinde keşfettiğiniz kurallar sadece periyodik tablodaki ilk 20 atom olan basit atomlar için geçerlidir. 4. katmandaki elektron sayısı elementin proton sayısı yani atom numarasına göre değişir. Ancak 2 ve 3. katmanlarda en fazla 8 olan elektron sayısı 4. katmanda 18 olabilir. Bu şekilde atom numarası arttıkça elektronlar, katmanlara içten dışa doğru 2, 8, 8 ve 18 şeklinde yerleşir ve katman sayıları da bu şekilde artar.
Atom modeli oluşturabilir misiniz?
Bunun için aşağıdaki etkinliği yapınız:
7.ETKİNLİK: Atom Modeli Canlandıralım
Malzeme listesi: 131. sayfadaki atom modelleri
Amaç: Atom modelini kavramak

Etkinliğin yapılışı
• Sınıfta üç grup oluşturunuz.
• İlk 20 element içinden en az 2 katmanlı bir element seçiniz. Seçtiğiniz elementin atom altı taneciklerinin sayısı, grup elemanlarından fazla olmamalıdır.
• Atom altı taneciklerin yerini grup üyeleri alacak şekilde bu elementin atom modelini nasıl yapacağınızı tartışınız. Grup üyelerinden proton, nötron ve elektronları canlandıracak kişileri belirleyiniz.
• Okul bahçesi veya spor salonu gibi boş bir alana atom çekirdeğini ve katmanları belirleyen çizgiler çiziniz.
• Atom altı taneciklerini temsil eden kişiler atomdaki yerlerini alsın. Yakalarına hangi yüke sahip olduklarını gösteren birer etiket taksınlar ve atomdaki görevlerine uygun rollerini oynasınlar.
• Oluşturduğunuz atom modelini defterinize çiziniz.
Sorular
1. Hangi elementin atomunu seçtiniz? Elektron, nötron ve proton rolleri için kaçar kişi görev aldı?
(N) Azot elementini seçtik. Elektron, nötron ve proton rolleri için 7’şer kişiden toplam 21 kişi görev aldı.
2. Elektron, proton ve nötronları temsil eden gruplardan hangisi, atomda nereye yerleşti?
Proton ve nötronlar atomun merkezine tam orta daireye 1. katmana 2 kişi elektron görevi için, 2. katmana 5 kişi elektron rolünü yerine getirmek için yerleştirler.
3. Elektron, proton ve nötronların yükleri nelerdir?
Elektronun yükü (-) negatif protonun yükü (+) pozitif nötronun yükü (0) nötr olmaktadır.
4. Katmanlardan hangisine kaç kişi yerleşti?
Merkeze 14 kişi yerleşti. 1. katman 2 kişi 2. katmana 5 kişi yerleşti.
5. Katmanlarda hareket eden elemanlar küresel yüzeydeki hareketi gerçekleştirebilir mi? Neden?
Katmanlarda hareket eden elemanlar küresel yüzeyde hareket edemezler çünkü, yerleşimimiz 2 boyutludur. Küre 3 boyutludur.
6. Katmanlarda hareket eden elemanların merkeze yığılmamak için ne yapmaları gerekti?
Katmanlarda hareket eden elemanlar merkeze yığılmamak için hızlı bir şekilde sürekli dönmeleri gerekmektedir.
7. Katmanlardaki elemanların merkezden kaçıp uzaklaşmaması için merkezdeki hangi taneciklerin, nasıl davranması gerekti?
Katmanlardaki elemanların katmanlardaki yerlerinden uzaklaşmaması için merkezdeki protonların onları çekmesi gerekti.
Yaptığınız etkinlikte seçtiğiniz elementin atom sıra numarasına göre proton, elektron ve nötron sayılarını belirlemiş oldunuz. Negatif (-) yüklü elektronları temsilen l. katmana 2 kişi yerleştikten sonra kalanlar sayısına göre diğer katmanlara yerleşmiş oldu. Katmanlarda hareket eden elemanlar merkeze yığılmamak için çok hızlı hareket etmiş olmalılar. Bu hareket bir çember üzerinde değil, küresel yüzeyde gerçekleşeceği için çeşitli yönlerde olmuştur. Katmanlarda hareket eden elemanlar birbirine çarpmamak için aralarında itme kuvveti uygulamışlardır. Katmanlardaki elemanların merkezden uzaklaşıp kaçmaması için ise merkezdeki pozitif (+) yüklü protonlar bir çekme kuvveti uygulamıştır.
Aynı elementin atomlarında protonların sayısının değişmediğini, bu nedenle de proton sayısının elementin sıra numarasıyla aynı olduğunu öğrendik. Öte yandan yaptığımız çeşitli etkinliklerde elektrikle yüklediğimiz cam çubuğun elektron verdiğini, plastik tarağın elektron aldığını biliyoruz. Böyle bir durumda cam çubuk veya plastik tarakta atomların elektron sayıları değişmektedir. Ancak cam çubuk veya plastik tarak başka bir maddeye dönüşmüyor. Buna göre bir atomun elektronlarının artması ya da azalması o atomu başka bir atoma dönüştürmez.
Acaba bir atomun elektronlarında olduğu gibi nötron sayısında da değişmeler olabilir mi?
Şekil 4.11’de verilen lityum elementine ait atom modellerini inceleyiniz. Defterinize bir tablo çiziniz. Lityum atom modellerindeki proton, elektron ve nötron sayılarını karşılaştırınız. Atom altı taneciklerden hangisinin sayısının değiştiğini belirleyiniz. Aynı elementin atomlarında hangi atom altı taneciğin sayısı değişmiştir?
Aşağıdaki örnekte görüldüğü gibi lityum atomunda proton sayısı değişmemiş, elektron sayısı değişmiştir. Bazı durumlarda nötron da değişebilmekte ama proton sayısı değişmemektedir.

Şekil 4.11: Nötron sayısı farklı lityum atom modelleri
Element atomlarının proton sayısı (atom numarası) değişmez. Ancak bazı element atomlarının elektron alış verişi yapması sonucu elektron sayısı değişebilir. Bazı elementlerin ise proton sayıları aynı olmasına rağmen nötron sayıları farklılık gösterebilmektedir (Şekil 4.12).

Şekil 4.12: Bir elementin atomlarında proton sayısı değişmediği hâlde nötron sayısı değişebilir.
Atom numarası verilen bir atomun elektron dizilim modelini çizebilir misiniz? Örneğin atom numarası 17 olan atomun elektron dizilimi aşağıdaki modellerden hangisidir? Neden? Açıklayınız
Aşağıda 3 örnekten, atom numarası 17 olan atomun elektron dizilimi ortadaki örnektir. Elektron dizilimi 1. katmanda 2 elektron, 2. katmanda 8 elektron, 3 katmanda 7 elektron olması gerekir. Bu durumu ortadaki örnek karşılamaktadır.
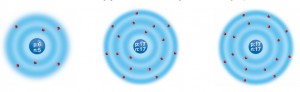
Proton sayısı 11 olan atomun elektron dizilim modelini nasıl çizersiniz? Bu atomda elektron sayısı kaçtır? Bu atom kaç katmandan oluşur? İçten dışa doğru bu katmanların hangisinde, kaç elektron yer alır? Bu soruların cevaplarını defterinize yazdıktan sonra modelinizi çiziniz. Modelinizi arkadaşlarınızın çizdiği modellerle karşılaştırınız.
Proton sayısı 11 olan atom modeli çizimi, bu atomda 11 elektron vardır. Bu atom 3 katmandan oluşur. içten dışa doğru 1. katmanda 2 elektron, 2 katmanda 8 elektron, 3 katmanda 1 elektron yer alır.






Son Yorumlar