Bir sıcaklık değişimi (yükselme ya da azalma), bir hal değişimi ya da kimyasal bir tepkimeyle belirlenen enerji biçimi.
Sıcaklık ve Isı Miktarı
Sıcak ve soğuk kavramları kuşkusuz en eski çağlardan beri bilinmektedir. Sözgelimi, Aristoteles’e göre sıcak ve soğuk, dünyada egemen olan dört ilkeden ikisidir. Bu ısı olaylarının genleşme gibi mekanik olaylara bağlanabildiği de gene uzun süreden beri bilinmektedir. Bir sıcaklık yükselmesinin görselleştirilmesini ya da saptanmasını sağlayan ilk aygıtlar, İ.Ö. II. yy’a kadar uzanır (Bizanslı Philon’un termoskopu), ancak ilk ısı ölçerin (termometre) 1612’de hekim Santorio tarafından yapıldığı ileri sürülmektedir. Isı ölçümü daha sonra hızla gelişmekle birlikte, kavramlar, ölçülerin duyarlılığına karşın, belirsiz kaldı. Nitelikleri farklı büyüklükler olan sıcaklıkla ısı miktarı açık seçik olarak birbirinden ayrılmadı. 1760’a doğru, hal değişimlerini inceleyerek bu ayrımı kesin bir biçimde ortaya koyan kişi İngiliz fizikçisi j. Black oldu. Sıcak bir cisimle soğuk bir cisim birbirine değdirildikleri zaman özellikleri (sözgelimi, hacimleri) zamanla değişip sonunda kararlı durumda kalırlar. İki cisim ısısal bir dengeye ulaşır; sıcaklıkları aynıdır. Üçüncü bir cisimle ısısal denge halindeki iki cisim kendi aralarında da ısısal dengede olduklarından, sıcaklığın basit bir ayar noktası değil, bütün cisimlere bağlı, gerçek bir parametre olduğu anlaşılır. Birbirine değen iki cismin etkileşimiyle oluşan bu denge, belli bir miktardaki ısı alışverişiyle elde edilir. Bu kavram, sıcaklık kavramına bağlı değildir. Gerçekten de, sıcak bir kurşun parçası soğuk bir kurşun parçasına değdirilse, soğuk olanın sıcaklığı artar; yani belli bir miktar ısı alır. Buna karşılık, sıcak bir kurşun parçası, içinde buz olan bir su kabının içine konursa, suyun sıcaklığı değişmez, ama belli bir buz kütlesi erir; kurşun, sabit sıcaklıkta buzun bir bölümünü eriten belli miktarda ısı verir.
Isı ve İş
XVIII. yy’da Lavoisier,Thomson,Fourier’in çalışmaları sonunda ısı, kütlenin mekanikteki niteliği gibi, yok olmayan bir kendilik olarak göz önüne alındı. Ancak bu korunum özelliği, salt ısı veren olaylarda ortaya çıkar; mekanik enerjinin (sürtünme, buharlı makine, vb.) işin içine girmesiyle de kaybolur. İş ve ısı birbiriyle açık ilişkisi olmayan deneysel olaylarla oluştuklarından, her şeyden önce birbirlerinden bağımsız büyüklüklerdir. Gerçekten, birçok durumda fiziksel bir sistem ısı alabilir ve durumu değişmeksizin iş yapabilir (ya da bunun karşıtı olabilir); sözgelimi, bir sürtünmeye uğrayan bir cisim ısınabilir, sonra da dışarıya belli miktarda ısı vererek başlangıç durumuna dönebilir; tersine, sıcak gazlardan ısı alan bir yanmalı motor, belirli bir iş, yani mekanik enerji üretebilir. Bu nedenlerle, XIX. yy’da, önce R. Mayer’in, daha sonra da joule, Hirn ve Colding’ in girişimleriyle iş ile ısının eşdeğerde oldukları ve iki enerji biçimi oluşturdukları düşüncesi doğdu. Bu koşullar altında iş ile ısının aynı birimle gösterilmesini engelleyecek bir şey yoktu. İşte bu nedenle, günümüzde ısı miktarı her türlü enerji için kullanılan bir ölçü birimi olan joule üe ölçülmektedir. İş ile ısının eşdeğer olmasından,hemen, bunların özdeş oldukları çıkarılmamalıdır. Bu konuda saatlerle ilgili klasik örneği verebiliriz. Bir saat ısıtılır ya da kurulursa, her iki durumda verilen enerji aynı olsa bile sonuç aynı değildir. Eşdeğerlik ilkesi, iki enerji biçiminden birinin (ısının ya da işin) yitimine, öteki biçimdeki (iş ya da ısı) benzer bir miktarın ortaya çıkışının denk düştüğünü belirtir ama, bu ilke iki işlemden her birinin, az ya da çok, kolaylığını belirlemez. Oysa işin, sözgelimi, sürtünmeyle ısıya tümüyle dönüşmesine karşılık, bunun tersinin asla doğru olmadığını (böylece bir otomobil motorunda yanmayla oluşan ısının bir bölümü atmosferi ısıtır) saptamak kolaydır. Isı, enerjinin bir azalma biçimi olarak ortaya çıkar; ısının madde içindeki yayılması, iletim ya da taşınmayla, boşluktaysa ışınım yoluyla sağlanır.
Kütlesel Isı, Gizli Isı ve Tepkime Isısı
Bir katı cisme ısı biçiminde gelen enerji, bu cismi oluşturan atomları harekete geçirir: Cisim ısınır ve sıcaklığı yükselir. Sonra ilk sıvı damlası ortaya çıkar: Verüen ısı, cismin bir katı olmasını sağlayan atomlararası bağları, erimeyi oluşturmak üzere, kesmeye yaradığından, sıcaklık tüm hal değimi (sabit basınçta) süresince sabit kalır; öte yandan, kimyasal tepkimeler ısısal olaylara yol açar. Bu üç olay türüne ısı alışverişi ve farklı türden ısı miktarları denk düşer. 1 başlangıç sıcaklığından t» son sıcaklığına geçişe neden olan Q enerjisi, incelenen cismin m kütlesine ve yapısına bağlıdır, c katsayısıysa cismin kütlesel ısısını gösterir. Buna göre Q =m.c.(tf-1) bağıntısı değiştokuş edi-len ısı miktarını gösterir. tf, t,’den daha büyükse cisim ısınır, daha küçükse cisim soğur. Kaü cisimlerin incelenmesi, billur yapısmdaki bir değişimin, c katsayısında bir değişime yol açtığım gösterir. Böylece, 95,6°C’ta atmosfer basıncı altında B kükürtünün P kükürtüne dönüşümü, 0,745 j.g~’. °C’,değerinden 0,778 Jg*’. °C değerine geçen bir c değişimiyle birlikte meydana gelir. Demir ve alüminyum gibi basit cisimlerin çoğu için A atom ağırlığının c kütlesel ısısıyla çarpımı normal sıcaklıkta, 25 j. °C” e yakındır. c katsayısı sıcaklıkla arttığından, karbon bu yasayı 1.500°C yakınında doğrular (Çiz. 1).Sıvılarda, en yüksek kütlesel ısısı bulunan sudur: 4,1855 J g’1 °C~1. Böylece, sıcak bir su kütlesi, bir ısı deposu gibi iş görür: Denizler, doğadaki sıcaklıkları düzenler ve iklimleri etkiler.
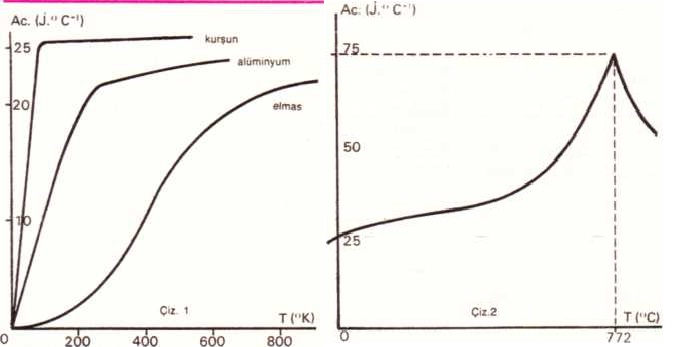
Sıcaklığın katı cisimlerin kütlesel ısısı ütüne etkisi
Gazların ısınmasına hacim ve basınçta büyük değişimler eşlik ettiğinden, sabit basınçtaki kütlesel ısı (cp) ile sabit hacimdeki kütlesel ısıyı(cv) birbirinden ayırt etmek gerekir. Gazm M mol kütlesi ile kütlesel ısısının çarpımı normal sıcaklıkta hemen hemen sabit kalır. Sözgelimi, tek atomlu gazlar (havadaki soy gazlar) için, şu değerler bulunur: McP =20,9 Mc» =12,6 j. °C~1; iki atomlu gazlar (hidrojen, oksijen) için: McP = 29,2 j.“C”’; Mc, = 20,9 j. °C”1 . Bu fark şöyle açıklanır: İki atomlu bir gazm sıcaklığını yükseltmek için yalnızca moleküllerin kinetik öteleme enerjisini değü, ağırlık merkezi çevresindeki kinetik dönme enerjüeriyle, atomların titreşim enerjisini de artırmak gerekir. t sıcaklığındaki saf bir cismin hal değişimindeki L gizli ısısı, cismin kütle birimini sabit sıcaklıkta, bir halden ötekine geçirmek için gerekli ısı miktarını gösterir. Q = m.L bağıntısı dönüşüm süresince bir m kütiesiyle değiştirilen enerjinin hesaplanmasını sağlar.
Böylelikle 0°C’ta buzun ergime ısısı 335 İ.g’’e, 100°C’ta suyun buharlaşma ısısı 2 256j.g1’e eşittir. Bütün bu büyüklükler sıcaklıkla değişir. Tepkime ısılarının tanımı, iyice belirlenmiş koşullan gerektirir. Gerçekten de. suyun bireşimi incelendiğinde (2 H2+O 2 – 2H20)başlangıçta çevre sıcaklığındaki hidrojen ile oksijenin tepkiyerek,sıvı ya da buhar evresi deneysel koşullara bağlı olan suyu oluşturduğu görülür. Isı olaylarını belirlemek için, tepkimenin sınır halleri bilinmelidir; genellikle, sıcaklıklar 25°C’ta tutulur. Öte yandan, tepkimenin hem sabit hacimde, hem de sabit basınçta gerçekleştiği varsayılır. Böylece, gaz halindeki oksijen ve hidrojenden 25°C’ta ve sabit basınçta 18 gr’lık suyun oluşması 285,9 kj açığa çıkarır.
Mikrokopik Kuvvetler
Verdiğimiz klasik tanım, uygulamalarla doğrulanmış çok genel nitelikli bazı öngerçeklerden doğar. XX. yy’ın başından beri, görünüşte sürekli olan maddenin gerçekte çok büyük sayıda taneciklerden oluştuğu bilinmektedir. Sistemlerin bütün olarak (makroskopik ölçek) incelenmesi, her tanecik üstüne etki yapan mikroskopik kuvvetlerin ortalama bileşkeleri olan kuvvetlerin (basınç kuvvetleri, vb.) tanımlanmasına yardım eder. Bu ortalama kuvvetlerin işinin, mikroskopik kuvvetlerin işinin ortalamasına eşit olmasını hiçbir şey sağlamaz: Niceliği oluşturan da işte bu farktır.
| KÜTLESEL İSI (sabit basınçta)
GAZ SICAKLIK KÜTLESEL ISI |
| Hidrojen |
16 |
14,264 |
| Helyum |
18 |
5,236 |
| Azot |
20 |
1,044 |
| Oksijen |
20 |
0,914 |
| Hava |
20-100 |
1,011 |
| Argon |
15 |
0,531 |
| Amonyak |
24-216 |
2,143 |
| Metan |
18-208 |
2,482 |
| Su buharı |
100-125 |
1,586 |
| BAZI KATİLARIN VE SIVILARIN | ||
| KÜTLESEL ISISI | ||
| CİSİM |
SICAKLIK KÜTLESEL ISI |
|
|
(°C) |
(kj/kg. °C) |
|
| Alüminyum |
18-100 |
0,911 |
| Gümüş |
18-100 |
0,234 |
| Bakır |
18-100 |
0,388 |
| Demir |
18-100 |
0,421 |
| Nikel |
18-100 |
0,454 |
| Kurşun |
18-100 |
0,129 |
| Platin |
20-100 |
0,133 |
| Cıva |
0 |
0,140 |
| Altın |
18 |
0,130 |
| Karbon (elmas) 11 | 0,469 | |
| Karbon (elmas) 140 | 0,929 | |
| Buz |
-40-0 |
1,804 |
| Sülfürik asit |
20 |
1,444 |
| Alkol |
20-26 |
2,423 |
| Benzen |
20 |
1,741 |
| Kloroform |
20 |
0,954 |






Son Yorumlar