Kimyasal bağ nedir? Çeşitleri nelerdir?
Kimyasal bağ ironik ve kovalent bağ şeklinde 2 çeşittir. Bu konumuzda iyonik bağ açıklanacak bundan sonraki konumuzda kovalent bağa yer verilecektir.

1. Fotoğraftaki molekül modellerinde kullanılan kürdanların görevi nedir?
Bu fotoğrafta kullanılan kürdanlar molekül modellerini birbirine bağlamıştır.
1. İyonik Bağ
Aynı veya farklı element atomlarının oluşturduğu moleküllerde atomları bir arada tutan bağlayıcı bir kuvvet var mıdır? Bu kuvvet ne olabilir?
Soruya burada cevap verildi.
Element modelleri yaparken kullandığımız kürdanları hatırlayınız. Atomların, molekülleri veya bileşikleri oluştururken aralarında modellerdeki kürdanın görevini yapan bağlayıcı bir unsur oluşur mu?
Aradaki kürdanın görevini gören, elektron alışverişi sonunda iyonik bağ oluşur.
Maddenin elektrikle yüklenmesinde, atomların kararlı hâlde bulunmasında ve iyon oluşumunda elektronların rol oynadığını gördük. Acaba atomlar arasında bağ oluşmasında da elektronlar rol alıyor olabilir mi?
Ataomlar arasında bağ oluşmasında iyon oluşumunun sebebi vardır.
Bu rolü yerine getirmek için elektronların atomda sürekli hareket ediyor olmasının bir etkisi olabilir mi?
Bu rolü yerine getirmek için atomda elektronlar sürekli hareket ederler.
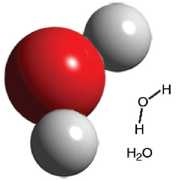
Şekil 4.14’teki su molekülünü oluşturan iki hidrojen atomu ile oksijen atomunun birbirine yakınlığı hakkında neler söyleyebilirsiniz? Atomların birbirine yakınlığı aralarında bir kimyasal bağ oluştuğunun göstergesi olabilir mi?
H2O Su molekülünde 2 hidrojen atomu ile 1 oksijen atomu arasında bir iyonik kimyasal bağ oluşmuştur.
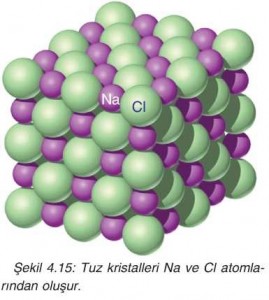
Şekil 4.15’te sofra tuzunun kristal modeli gösterilmiştir. Tuz modelinde bulunan atomlar arasındaki
uzaklığa bakarak hangi atomların aralarında bağ oluşturduğunu söyleyebilir miyiz?
Modeli incelediğimizde Na atomları ile Cl atomlarının birbirine temas ettiğini, Na veya Cl atomları
arasında boşluklar olduğunu veya bunların birbirinden daha uzak olduğunu görebiliriz. Bir bileşik olan sofra tuzunun formülü NaCl (sodyum klorür)’dür. Buna göre modelde birbirine daha yakın olan Na ve Cl atomlarının birbirine bağlanarak NaCl bileşiğini oluşturduğunu söyleyebiliriz.
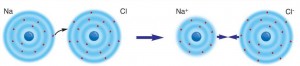
Sodyum ve klorun atom modellerini kullanarak NaCl bileşiğindeki Na ve Cl atomlarından hangisinin anyon, hangisinin katyon olduğunu bulalım.
Sodyumun son katmanında bir elektron, klor atomunun son katmanında ise yedi elektron bulunmaktadır. Kararlı yapıya ulaşmak için sodyum atomu, son katmanındaki bir elektronunu vermek, klor atomu da dış katmanındaki yedi elektronu bir elektron alarak sekize tamamlamak ister. Bu durumda sodyum atomu bir elektronu klor atomuna verir ve +1 yüklü sodyum katyonuna dönüşür. Klor atomu da sodyum atomunun verdiği bir elektronu alarak -1 yüklü klor anyonuna dönüşür. NaCl bileşiğinde sodyum Na+, klor ise Cl- iyonu şeklinde bulunur (Şekil 4.16).
Na+ iyonu ile Cl- iyonlarının birbirine yakın, iki Na+ veya iki Cl- iyonunun birbirine uzak olmasının nedeni nedir? Hangi iyonlar arasında bir bağ olması beklenir? Tahmin ediniz. Tahminlerinizi arkadaşlarınızla paylaşınız. Bu olayı iyonların yükleriyle ilişkilendirerek açıklayabilir misiniz?
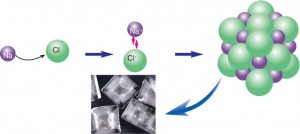
Atomların birbirine yakın veya uzak durmasının sebebi elektrikle yüklü iyonların birbirine uyguladığı çekme veya itme kuvvetidir. Atom modellerinde atomlar arasındaki uzaklıklara bakarak birbirine en yakın duran atomlar arasında “kimyasal bağ” olduğunu söyleyebiliyoruz.
NaCl kristalinde, aralarındaki itme kuvveti nedeniyle bir klor anyonu (Cl-) diğer bir klor anyonundan ve bir sodyum katyonu (Na+) diğer bir sodyum katyonundan uzaklaşmaya çalışırken bir (Cl-) anyonu ile bir (Na+) katyonu birbirine yaklaşır. Zıt yüklü iyonlar arasındaki bu elektriksel çekim kuvveti iyonik bağ olarak adlandırılır. İyonik bağ, elektron alma eğilimindeki atomla elektron verme eğilimindeki atom arasında oluşur. Sodyum ve klor atomları arasındaki iyonik bağ oluşumu Şekil 4.17’de gösterilmiştir. Şekli inceleyerek anlatılmak istenen olayı sözlü olarak ifade ediniz.






Comments